TCR-T细胞治疗,即T细胞受体(T Cell Receptor, TCR)基因修饰的T细胞治疗,是一种通过基因工程技术改造患者自身的T细胞,使其能够特异性识别并攻击肿瘤细胞的新型免疫疗法。 TCR是T细胞表面的一种重要分子,能够识别并结合抗原,从而激活T细胞发挥免疫作用。在TCR-T细胞治疗中,研究人员首先从患者体内分离出T细胞,然后通过基因工程技术将这些T细胞的TCR替换为能够特异性识别肿瘤细胞的TCR,最后将这些改造后的T细胞回输到患者体内,从而实现对肿瘤细胞的特异性攻击。 近年来,TCR-T细胞治疗在实体瘤(肝癌、胰腺癌、肺癌、胃癌)的治疗中取得了显著的进展。例如,一款名为KIMMTRAK的药物已经成功获得了美国食品药品监督管理局(FDA)的批准,用于治疗转移性葡萄膜黑色素瘤。这一药物的获批是基于一项名为IMCgp100-202的3期临床试验结果。该试验共入组了378名HLA-A*02:01阳性的转移性葡萄膜黑色素瘤患者,并将其随机分为两组。 其中,一组接受KIMMTRAK治疗,另一组接受伊匹单抗、派姆单抗或达卡巴嗪等标准治疗。结果显示,与对照组相比,KIMMTRAK单药治疗显著降低了葡萄膜黑色素瘤的病情进展或死亡风险,使其降低27%。这一成果为TCR-T细胞治疗在实体瘤领域的应用提供了有力的证据。 图. 评估TCR-T细胞疗法潜在毒性的方法(参考来源7) 【参考文献】 1. Lijun Zhao and Yu Cao. "Engineered T Cell Therapy for Cancer in the Clinic." Frontiers in Immunology (2019). 2. P. Shafer, L. Kelly et al."Cancer Therapy With TCR-Engineered T Cells: Current Strategies, Challenges, and Prospects." Frontiers in Immunology (2022). 3. Estelle Baulu, Célia Gardet et al. "TCR-engineered T cell therapy in solid tumors: State of the art and perspectives.Science Advances (2023). 4. Jianxiang Zhang and Lingyu Wang."The Emerging World of TCR-T Cell Trials Against Cancer: A Systematic Review." Technology in Cancer Research and Treatment (2019). 5. F. Manfredi, B. Cianciotti et al. "TR Redirected T Cells for Cancer Treatment: Achievements, Hurdles, and Goals." Frontiers in Immunology (2020). 6.M. Arnaud, S. Bobisse et al. "The Promise of Personalized TCR-Based Cellular Immunotherapy for Cancer Patients." Frontiers in Immunology (2021). 7. TCR-engineered T cell therapy in solid tumors: State of the art and perspectives. DOI:10.1126/sciadv.adf3700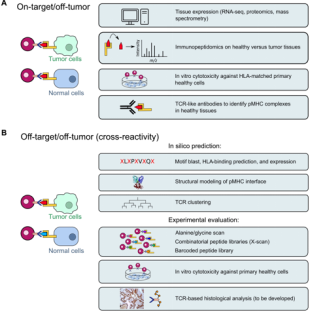

咨询热线:
010-56350526
机构合作:
010-56350526
