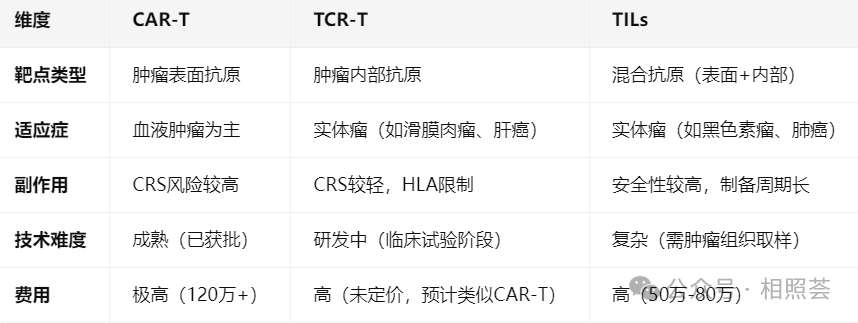
在肿瘤治疗领域,细胞免疫疗法已成为继手术、放疗、化疗后的“第四支柱”。其中,CAR-T、TCR-T、TILs三大T细胞疗法凭借精准靶向、持久抗癌的特性,成为医学界的研究热点。但它们究竟有何区别?哪种疗法更适合特定患者?本文将从原理、适应症、优劣势等角度,为您深度解析。 原理: 适应症: 优势: 靶向性强:直接识别肿瘤表面抗原,避免误伤正常细胞。 疗效显著:对血液肿瘤的缓解率远高于传统化疗。 个体化定制:从患者自身血液中提取T细胞,避免排斥反应。 局限性: 实体瘤效果有限:实体瘤表面抗原异质性高,且肿瘤微环境抑制免疫细胞活性。 副作用风险:可能引发细胞因子释放综合征(CRS)和神经毒性,需严密监测。 费用高昂:国内单次治疗费用约120万-180万元,且尚未纳入医保。 原理: 适应症: 优势: 靶点范围广:可识别细胞内抗原,突破实体瘤表面抗原异质性的限制。 副作用较轻:CRS反应相对温和,且T细胞具有免疫记忆功能,长期疗效更持久。 个体化精准:根据患者肿瘤抗原特征定制TCR,提高治疗针对性。 局限性: HLA限制性:仅适用于HLA(人类白细胞抗原)匹配的患者,受益人群有限。 技术门槛高:TCR筛选和优化需大量临床数据支持,目前仍处于临床试验阶段。 原理: 适应症: 优势: 天然抗癌性:直接利用肿瘤组织中的免疫细胞,无需基因编辑,安全性更高。 多靶点攻击:混合淋巴细胞群体可识别多种肿瘤抗原,降低逃逸风险。 持久性强:回输后可在体内长期存活,形成免疫记忆。 局限性: 细胞培养难度大:需从肿瘤组织中分离足够数量的活性淋巴细胞,成功率受肿瘤类型和患者状态影响。 制备周期长:从取样到回输需数周时间,可能延误治疗窗口。 费用高昂:单次治疗费用约50万-80万元,且需多次输注。 选择建议(仅供参考): 血液肿瘤患者:优先选择CAR-T疗法,尤其是复发难治性病例。 实体瘤患者:若HLA匹配且肿瘤表达特定内部抗原,可尝试TCR-T;若肿瘤组织可获取且淋巴细胞活性高,TILs是优选。 经济条件有限者:可关注国内临床试验项目(如复旦大学附属肿瘤医院),部分疗法可免费参与。 CAR-T、TCR-T、TILs三大疗法各有千秋,CAR-T在血液肿瘤中“一骑绝尘”,TCR-T为实体瘤带来新希望,TILs则深耕肿瘤微环境。随着技术进步,它们将共同改写癌症治疗格局,为患者点亮生命之光。 温馨提示:本文信息仅供参考,具体治疗方案需由专业医生根据患者病情、基因检测结果等综合评估。
CAR-T(嵌合抗原受体T细胞疗法)通过基因编辑技术,给患者自身的T细胞装上“导航系统”——嵌合抗原受体(CAR)。这个“导航”能精准识别肿瘤细胞表面的特定蛋白(如CD19、BCMA),引导T细胞定向杀伤癌细胞。
目前全球已获批的CAR-T疗法主要用于血液肿瘤,如复发/难治性大B细胞淋巴瘤、急性淋巴细胞白血病、多发性骨髓瘤等。临床数据显示,部分患者经CAR-T治疗后生存期超过10年,客观缓解率可达80%。
TCR-T(T细胞受体工程化T细胞疗法)通过基因编辑,让T细胞表达能识别肿瘤内部抗原的T细胞受体(TCR)。与CAR-T不同,TCR-T可穿透肿瘤细胞膜,识别细胞内抗原(如MEAG-A4、NY-ESO-1),这些抗原通常由肿瘤特异性基因突变产生。
TCR-T在实体瘤治疗中潜力巨大,尤其针对滑膜肉瘤、黑色素瘤、肝癌、宫颈癌等。2024年8月,美国FDA加速批准首款靶向MEAG-A4的TCR-T疗法用于滑膜肉瘤,成为实体瘤细胞治疗的里程碑。
TILs(肿瘤浸润淋巴细胞疗法)直接从患者肿瘤组织中提取浸润的淋巴细胞(包括T细胞、NK细胞等),这些细胞已在肿瘤微环境中“历练”,具备识别肿瘤抗原的能力。通过体外扩增和激活后,再回输至患者体内,形成一支“抗癌特种部队”。
TILs疗法在实体瘤中表现突出,尤其适用于黑色素瘤、非小细胞肺癌、头颈癌等。2024年2月,美国FDA批准首款TILs产品用于免疫治疗进展后的恶性黑色素瘤。

咨询热线:
010-56350526
机构合作:
010-56350526
