近年来,淋巴瘤的治疗手段不断革新,CAR-T细胞疗法与放疗的联合应用,为复发难治性淋巴瘤患者带来了新的希望。这种“双剑合璧”的治疗模式,不仅显著提升了肿瘤清除率,更让许多原本无药可治的患者重获新生。本文将为您详细解析CAR-T联合放疗的原理、优势及最新临床进展。 CAR-T细胞疗法自2017年在中国获批上市以来,已成为复发难治性B细胞淋巴瘤的“终极武器”。其原理是通过基因编辑技术,将患者自身的T细胞改造为携带嵌合抗原受体(CAR)的“超级战士”,精准识别并杀灭肿瘤细胞。然而,临床实践逐渐暴露出两大难题: 神经毒性风险高:中枢神经系统(CNS)受累的淋巴瘤患者中,约30%在接受CAR-T治疗后出现免疫效应细胞相关神经毒性综合征(ICANS),表现为意识模糊、癫痫发作甚至昏迷,严重时可危及生命。 缓解持续时间短:单药CAR-T治疗的1年无进展生存率(PFS)仅约40%,部分患者因肿瘤抗原逃逸或微环境抑制导致复发。 “CAR-T就像一把精准的手术刀,但面对体积巨大或位置特殊的肿瘤时,单靠它可能力不从心。”北京协和医院血液内科主任医师张薇比喻道。 放疗与CAR-T的联合,并非简单叠加,而是通过“时空协同”实现1+1>2的疗效。临床研究揭示了三大核心机制: 放疗可通过高能射线直接破坏肿瘤细胞DNA,使其裂解释放大量肿瘤抗原。这一过程不仅缩小肿瘤体积,还能“预激活”免疫系统。北京高博医院的研究显示:27例接受WBRT桥接治疗的患者,放疗后肿瘤客观缓解率(ORR)达81.5%,其中近半数肿瘤完全消失;随后进行CAR-T治疗时,严重细胞因子释放综合征(CRS,≥3级)的发生率从单药治疗的20%降至7.4%。 CNS是淋巴瘤常见的复发部位,但血脑屏障会阻碍CAR-T细胞进入。放疗可通过破坏血管内皮细胞间的紧密连接,暂时打开血脑屏障的“大门”。2025年《Blood Advances》发表的一项研究纳入127例高危B细胞淋巴瘤患者,发现接受桥接放疗者CAR-T治疗后的CNS复发率较未放疗组降低62%,2年总生存率(OS)提高至53%。 肿瘤微环境中充斥着免疫抑制性细胞(如Tregs、MDSCs)和细胞因子(如TGF-β、IL-10),它们像“盾牌”一样保护肿瘤细胞。放疗可通过诱导肿瘤细胞免疫原性死亡,释放“危险信号”(如HMGB1、ATP),招募更多免疫细胞进入肿瘤组织。浙江大学医学院附属第一医院团队在肝癌模型中发现,放疗联合CAR-T治疗可使肿瘤内CD8+ T细胞浸润增加3倍,肿瘤缩小率从单药治疗的30%提升至90%。 图:创客贴 这种联合治疗方案的成功并非偶然,其背后的科学机制主要包括: 1. 放疗为CAR-T细胞开辟道路 2. 激活全身免疫反应 3. 改变肿瘤微环境 北京某医院的研究中,27例接受WBRT+CAR-T联合治疗的患者,1年PFS率和OS率分别达61.3%和56.6%,远超历史单药CAR-T治疗的20%-30%。更令人振奋的是,85.2%的患者达到完全缓解(CR),其中70%持续缓解超过1年。 北京某专家团队针对左侧颈部巨大包块(直径>10cm)的弥漫大B细胞淋巴瘤患者,采用超分割放疗(每日2次、总剂量30Gy)联合CAR-T治疗。结果显示:放疗后肿瘤体积缩小60%,乳酸脱氢酶(LDH)从>1000 U/L降至正常;CAR-T回输后患者达到完全缓解,至今已无病生存2年,而同类患者单药CAR-T治疗的2年OS率仅约30%。 2025年ASCO年会上,一款靶向CD19/CD20的双靶点CAR-T疗法(KITE-363)联合放疗的I期临床试验数据引发热议:在23例初治复发难治性B细胞淋巴瘤患者中,客观缓解率(ORR)达87%,完全缓解率(CR)高达78%;在7例接受过2线以上治疗的患者中,ORR和CR率均达100%。研究负责人指出:“放疗不仅为CAR-T细胞‘清扫战场’,双靶点设计还能有效防止肿瘤抗原逃逸,这是缓解率大幅提升的关键。 1. 哪些患者适合联合治疗? 复发难治性B细胞淋巴瘤(如弥漫大B细胞淋巴瘤、滤泡性淋巴瘤转化型) 肿瘤体积较大(>5cm)或存在结外受累(如肝、脾、骨髓) 血清LDH水平升高(提示肿瘤负荷重) 既往CAR-T治疗失败或CNS受累的高危患者 细胞采集:外周血单采,获取足够T细胞; 桥接治疗:根据病情选择放疗/化疗,控制肿瘤进展; CAR-T制备:需2-4周,期间密切监测病情; 淋巴细胞清除:回输前3天使用氟达拉滨+环磷酰胺化疗,清除免疫抑制细胞; CAR-T回输:分次输注,监测过敏反应; 放疗介入:回输后1-2周,对残留病灶进行精准照射。 CRS:多数为1-2级(发热、乏力),通过托珠单抗(抗IL-6受体单抗)和糖皮质激素可控制; ICANS:1-2级(头痛、意识模糊)占80%,使用甘露醇降颅压、甲泼尼龙抗炎后多可缓解; 血液学毒性:放疗和化疗可能导致白细胞、血小板减少,需定期输注支持治疗; 长期影响:CAR-T治疗可能导致B细胞缺乏,需定期输注免疫球蛋白预防感染。 生物标志物指导:通过CAR-HEMATOTOX评分预测血细胞减少风险,提前调整放疗剂量; 新型CAR结构:双特异性CAR-T细胞(如CD19/CD22双靶点)联合放疗,降低抗原逃逸风险; AI辅助设计:利用人工智能优化放疗计划与CAR-T回输时序,实现疗效最大化。 CAR-T联合放疗的兴起,标志着淋巴瘤治疗从“单一模式”向“多维度整合”的跨越。对于复发难治性患者,这一方案不仅提升了肿瘤清除率,更通过科学时序安排与副作用管理,让“不可治愈”变为“长期存活”。未来,随着技术的不断突破,更多患者将从中受益,重获健康人生。 【温馨提示】本文仅为医学科普知识,不能替代专业诊疗意见。具体治疗方案请咨询医疗机构及相关专业人士。
1. 肿瘤减负:降低“细胞因子风暴”风险
2. 血脑屏障穿透:攻克“脑部禁区”
3. 微环境重塑:从“抑制”到“激活”
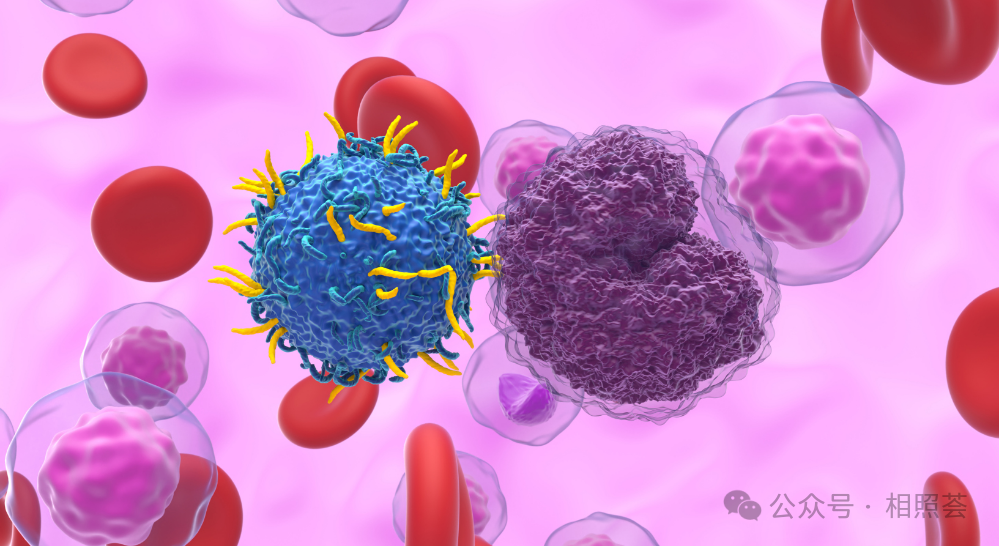
放疗能够破坏肿瘤内部的物理屏障和免疫抑制微环境,为CAR-T细胞进入肿瘤组织并发挥作用创造有利条件。
局部放疗不仅能消灭照射区域的肿瘤细胞,还能释放肿瘤特异性抗原,激活全身性免疫反应,这与CAR-T治疗形成完美互补。
放疗可改变肿瘤周围的微环境,使其从免疫抑制状态转变为免疫支持状态,提高CAR-T细胞的存活和活性。1. 复发难治性CNS淋巴瘤:完全缓解率从40%跃升至85%
2. 大包块/高危淋巴瘤:2年生存率翻倍
3. 双靶点CAR-T+放疗:完全缓解率突破78%
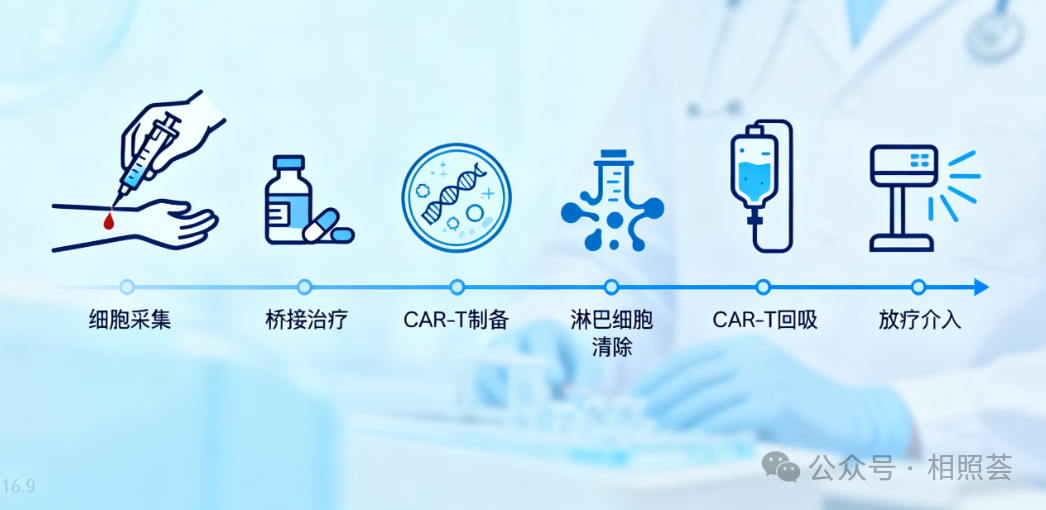
2. 治疗流程是怎样的?
3. 副作用如何管理?

咨询热线:
010-56350526
机构合作:
010-56350526
